주식회사 큐라티스
인류의 공중보건에 앞장서는 소셜임팩트 기업이 되기를 희망합니다.
CMO & CDMO
Contract Development and Manufacturing Organization
- HOME
- 사업영역
- CMO & CDMO
(임상시험용)의약품 GMP 제조
-
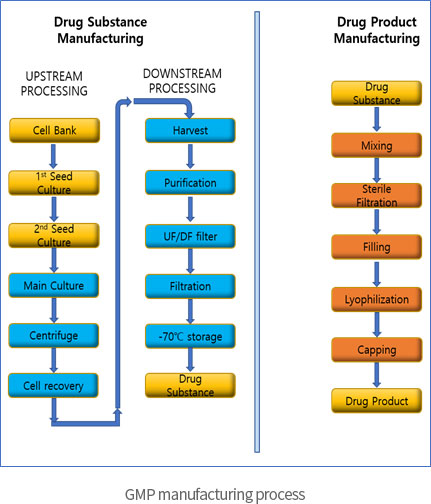
→ 유전자재조합 기반의 cGMP 제조시설 및 풍부한 업무경험 보유
- ∙ 임상시험용)의약품 cGMP 제조 적합시설(2020년 인증 예정)
- ∙ 소용량 및 대용량 생산에서 재현 가능한 생산 공정 개발
- ∙ 미생물배양 기반 바이오의약품의 (임상시험용)의약품 cGMP 제조 및 제조공정 기술 보유
- ∙ 액상주사제, 동결건조주사제의 (임상시험용)의약품 cGMP 제조 및 제조공정 기술 보유
- ∙ 국내/외 규제기관의 실사 경험을 보유한 QA 전문인력 보유
- ∙ cGMP, EU-GMP, KGMP의 규정과 ICH 지침을 포괄하는 Quality program(Quality system, Facilities & Equipment, Materials, Productions, Packaging & Labeling, Laboratory control) 보유
- ∙ cGMP 제조소 : Grade A/B(무균시설), Grade C/D(미생물관리구역), CNC(Controlled not classified)
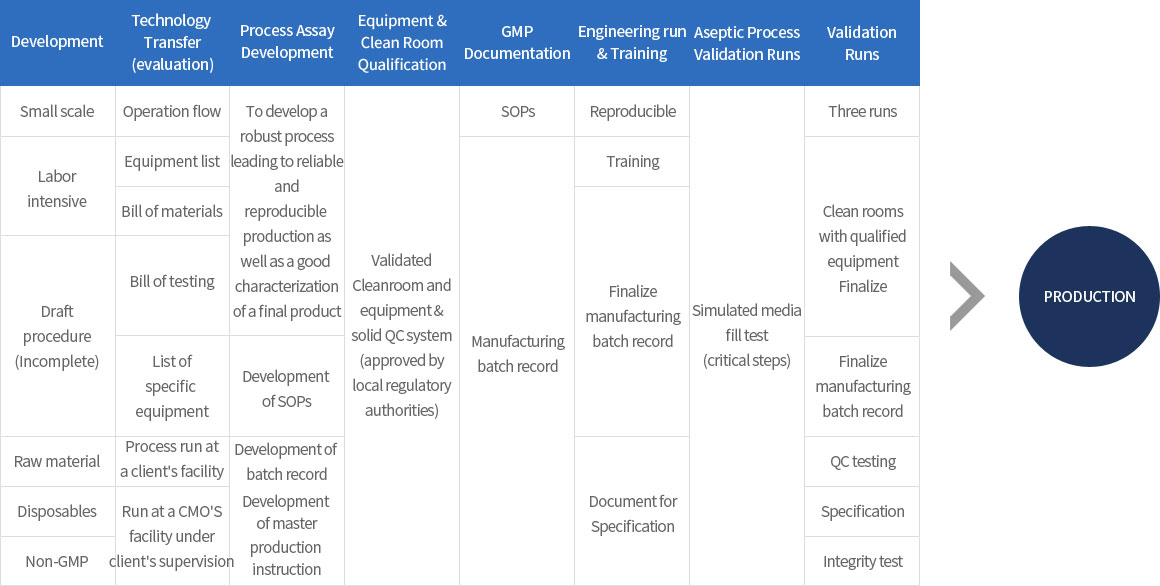
∙ 유전자재조합 기반의 바이오의약품 개발 프로세스
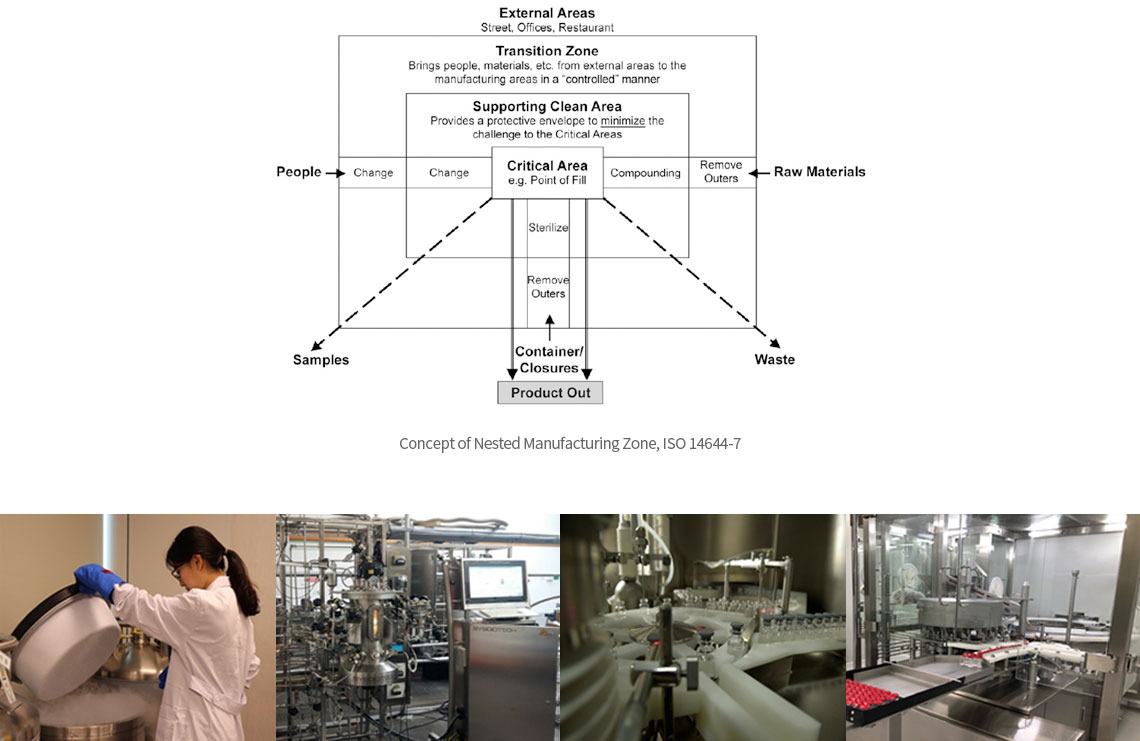
∙ 유전자재조합 원료의약품 및 완제의약품의 (임상시험용)바이오의약품에 대한 GMP 제조공정 및 밸리데이션 서비스 제공
(임상시험용)의약품 GMP 제조
-
→ 미생물배양 기반 유전자재조합 바이오의약품의 DS, DP에 대해개발 초기단계부터 R&D 및 비임상시험용의약품의 생산 서비스 제공
- ∙ 유전자재조합 세포주(E.coli) 배양 및 정제 공정
- ∙ 액상주사제 및 동결건조주사제
- ∙ 분석법 개발(Identity, Quantity, Potency, Impurities)

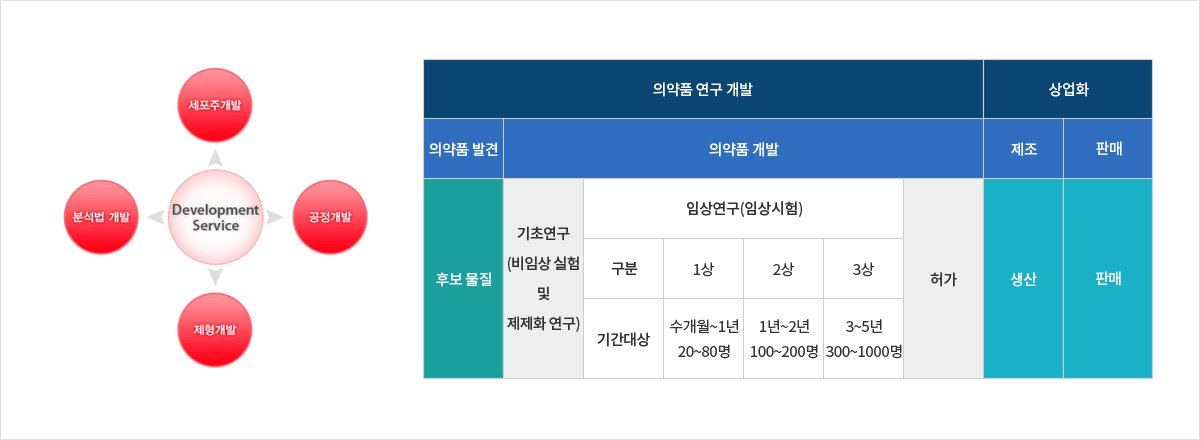
Custom Services
-
→ 바이오의약품 원료 및 완제의약품 제조공정 개발 등 Custom Services
- ∙ 유전자재조합 의약품에 사용되는 세포주 스크리닝
- ∙ 사용자 요구수준을 만족하는 배양조건 및 정제조건 개발
- ∙ Drug Substance 배양 및 정제공정의 최적화
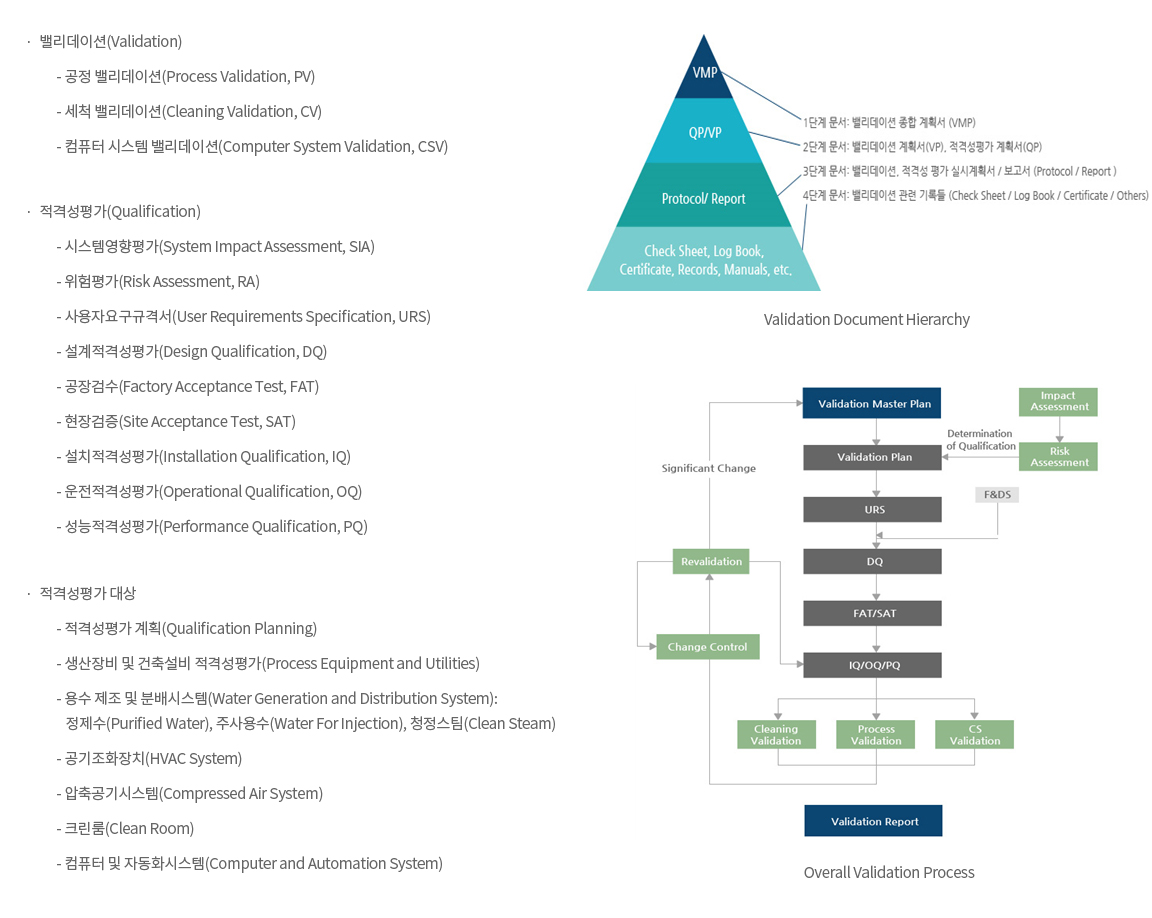
- ∙ 밸리데이션(Validation) 및 인허가(Regulatory Affairs) 서비스 전문기업
-
→ 배양공정개발
- ∙ 세포배양 조건 개발 및 개선
- ∙ 배양공정개발: Batch, Fed-batch, seed culture
- ∙ Drug Substance 배양 및 정제공정의 최적화
- ∙ 밸리데이션(Validation) 및 인허가(Regulatory Affairs) 서비스 전문기업
-
→ 정제공정개발
- ∙ 공정 개선 및 최적화
- ∙ Purification process개발
- ∙ UF/DF membrane의 type & sizing 시험
- ∙ 정제공정 셋업
-
→ 스케일업 연구
- ∙ 50 L/500 L 규모 공정 셋업 및 분석
- ∙ (비)임상시료 생산을 위한 공정이전
-
→ 제형개발 연구
- ∙ 단백질, 부형제물 조성을 위한 제형개발을 통해 제품의 특성 및 안정성 최적화
- ∙ 액상주사제 및 동결건조주사제 제형 개발
-
→ 분석법 개발/지원
- ∙ 제품별 특성에 적합한 분석법 개발(Identity, Quantity, Purity, Potency, Impurities, Endotoxin, Physico-chemical tests)
- ∙ 분석법 밸리데이션(Specificity, Accuracy, Precision, Detection Limit, Quantitation, Limit, Linearity, Range, Robustness)
- ∙ 안정성 시험(stability test) 연구
-
→ 밸리데이션
- ∙ 밸리데이션(Validation)/적격성평가(Qualification) 가이드라인에 규정된 절차 수행